メンバー
喜納 宏昭 キノウ ヒロアキ

研究内容(研究キーワード)
(がん治療、ナノミセル、がん免疫、老化制御)
抗癌剤を封入した高分子ミセルの3つの治験がPhase IIで進行中である。抗癌剤ミセルに加えて、昨年(2020年)より、新たにsiRNAのデリバリーシステム(DDS)の医師主導治験が開始されており、様々な用途で高分子ポリマーが新しいDDSとして実用化に向けて治験が進行している。最近の治験では、頭頚部がんに対するシスプラチンミセルとキートルーダの併用(第2相)が開始しており、また前臨床研究において、エピルビシンミセルと免疫チェックポイント阻害剤(ICI)の併用が免疫チェックポイント阻害剤耐性の脳腫瘍モデルで高い効果があることなど、ミセルとICIとの併用した化学免疫療法の有効性を示すデータが集まりつつある。ICIとミセルとの併用は、CD8, 樹状細胞などががん内へ浸潤し、飛躍的に高い抗腫瘍効果が示されている。また、新たなDDSとして免疫チェックポイント阻害剤を免疫関連有害事象(immune-related adverse events: irAE:間質性肺炎など)を回避しながら、脳へICIを運ぶリガンド搭載デリバリーシステムの開発も報告している。ここでは、高分子ミセルと免疫チェックポイント阻害剤を併用した化学免疫療法を中心に最近の研究である免疫チェックポイント阻害剤の脳へのデリバリーシステムについても解説する。
はじめに
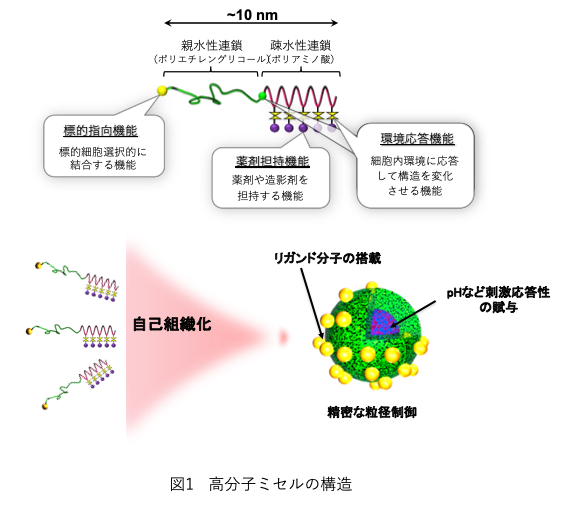
高分子ミセルは、構成するブロック共重合体の精密設計と分子修飾により、任意の薬剤の搭載と放出制御、30-70nmでの精密な粒径制御、標的指向性や環境応答性の賦与といった目的に応じた最適化と高機能化が可能であることから、従来のリポソームなどのDDS技術とは大きく異なるナノDDS技術であり(1)(図1)、3種類の抗がん剤内包ミセルと核酸医薬搭載複合体が臨床治験に進んでいる(図2)。抗癌剤内包ミセルは、高分子薬剤が腫瘍へ集積するEPR(enhanced permeability and retention)効果によって癌へ集積し、がん環境中に応答して、がん細胞へ抗癌剤を放出し、高い抗腫瘍効果をしめす。さらに正常細胞への抗癌剤の集積、放出を最小限にすることによって、副作用を抑えることを可能にしている1)。本稿では、現在、治験まで進んでいる開発中の高分子ミセルと免疫チェックポイント阻害剤を組み合わせた研究を中心に解説する。■高分子ミセルと免疫チェックポイント阻害剤の組合せによる化学免疫療法
① 免疫チェックポイント阻害剤 (Immuno-checkpoint inhibitor : ICI)
近年の急速な腫瘍免疫研究の進歩により、がん免疫逃避機構が明らかになり、T細胞性免疫を抑制する2つの補助シグナル(免疫チェックポイント) CTLA-4およびPD-1経路を阻害する免疫チェックポイント阻害剤(Immuno-checkpoint inhibitor : ICI)は、臨床においてもがんの有力な治療法の1つとして確立されている。ICIは、さまざまながん種(メラノーマ、非小細胞肺がん、頭頚部がん、腎がん、悪性中皮腫など)に適応が拡大され、高い効果をあげているが、次の様な問題点が指摘されている。(1)単剤での奏効率は約10-30%と低く、多くの患者に対して効果がない。(2) ICIには、免疫関連有害事象(immune-related adverse events: irAE) という独特な副作用(間質性肺炎,大腸炎,甲状腺 機能低下症,肝障害など)がある。奏効率の低さを是正するために、化学療法と免疫療法を組み合わせて使う化学免疫療法 (Chemo-Immunotherapy: CIT)の臨床治験が多く試みられている。
② エピルビシンミセルと免疫応答誘導性細胞死(ICD)
従来の殺細胞性抗がん剤や放射線治療(RT)の免疫応答のメカニズムが解明されつつあり,その有望な効果が明らかになってきている。アントラサイクリン系抗がん剤は,がん細胞が死滅してがん抗原が放出されると免疫応答誘導性細胞死(ICD)が誘導され,免疫応答を惹起して,腫瘍細胞を細胞死に至らせることがあきらかになっている。 ICDとは、殺細胞性抗がん剤や放射線治療 によってがん細胞が死ぬことによって、がん細胞膜表面に、CRT(Calreticulin) の表出、および がん細胞からのHMGB1(High Mobility Group Box 1)の放出など (Eat me シグナル) が確認され、そのシグナルは未成熟な樹状細胞にあるそれぞれの受容体を経由して、未熟な樹状細胞を成熟した樹状細胞へと誘導する(7)。ICDの効果は、エピルビシンを含むアントラサイクリン系の抗癌剤がもっとも免疫の誘導能が高いことが示されており(8)、副作用の軽減とがんへの集積のすぐれたエピルビシンミセルが in vivoにおいて高いICD効果が得られると考えられる。
③ エピルビシンミセルとICIの化学免疫療法は、飛躍的に抗腫瘍効果を高める
ICI耐性CT2A(PTEN 欠失株))同所モデルを作製し、エピルビシンミセルとICIによる化学免疫療法の優位性を検証した(9)。脳腫瘍患者の報告と同様に、PTEN を欠失したCT2A株モデルでは、ICI投与(aPD1群)に対して治療抵抗性を示した。エピルビシンミセルは、エピルビシン単体を投与した場合と比べて 160倍腫瘍組織への集積し、正常な脳組織と腫瘍組織で AUCを比較すると、67倍腫瘍組織の方が高く、ナノミセル のエピルビシン脳移行性がGBM組織で顕著に高いことがわかった。全身投与によって生存期間を評価すると、併用療法の90%が70日以上生存し、顕著な延命効果を確認できた(図3A)。また、腫瘍浸潤T細胞 (TIL)の割合を確認すると、併用療法が、がんの内部への浸潤しているT細胞およびM1 macrophage(活性化型macrophage )、樹状細胞(DC)の数が大幅に増加し、反対に、骨髄由来免疫抑制細胞 (MDSC)の細胞が減少していることがわかった。このエピルビシンミセルを使用した化学免疫療法は、ICIの効果のある患者の割合をあげるのみでなく、ICIの適応のなかった脳腫瘍においてもすぐれた相乗効果があることをモデルによって証明した。

■免疫チェックポイント阻害剤(ICI)の脳へのデリバリーシステム
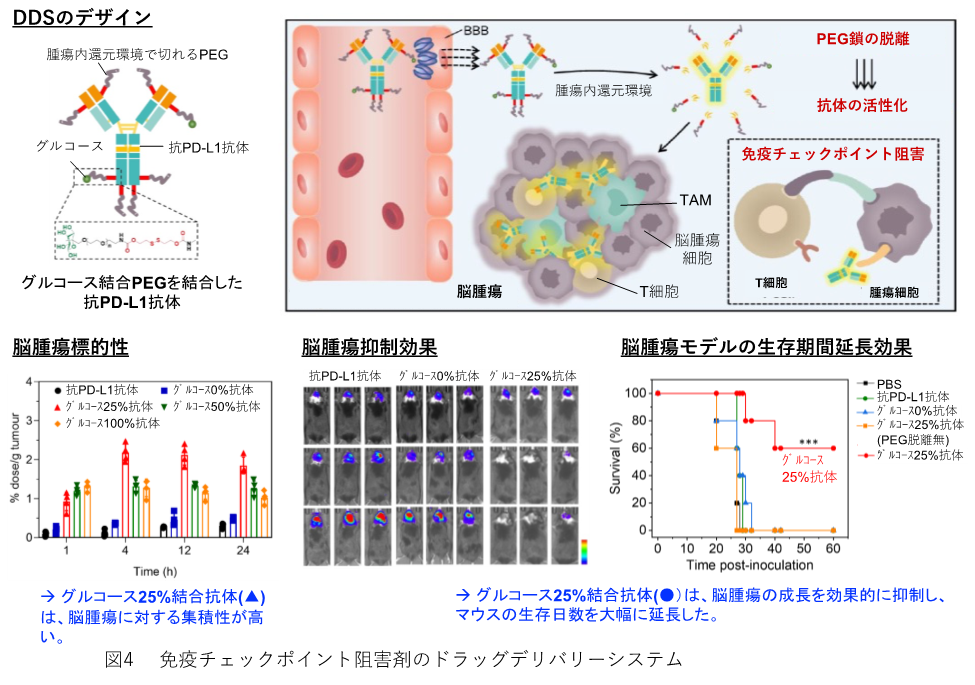
ICIには、前述のように免疫関連有害事象(immune-related adverse events: irAE) という独特な副作用がある。我々は、以前、脳の血管内皮細胞に発現するグルコーストランスポーターに注目し、血中のグルコース濃度を上昇させることによってグルコーストランスポーターを誘導し、グルコース搭載ミセルによって薬剤を脳へデリバリーすることに成功している。(10)。最近、このグルコースポリマーとがん環境中の還元状態を利用して、免疫チェックポイント阻害剤の脳へのデリバリーに成功した(図4)。図に示すように、抗体にS-S結合でリガンドPEGポリマーを結合させることによってタンパク質などの非特異的な結合を回避し、体内を循環し、がんへEPR効果によって集積し、腫瘍内の還元環境でPEGポリマーが脱離して、抗体が機能する。ポリマーのグルコースの結合の割合が、25%のものが最も脳腫瘍に集積し、抗腫瘍効果も高かった。前述のICD誘導と免疫チェックポイント阻害剤DDSを用いることによってより副作用の少ないがん治療が実現すると考えている。
略歴
-
平成 6年
金沢大学大学院自然科学研究科生命科学専攻卒業
博士(理学)取得 -
平成 6年
金沢大学がん研究所研究協力員
-
平成 8年
富山医科薬科大学医学部第二生化学教室 助手
-
平成 9年
東京大学医科学研究所癌細胞研究部
中核的研究機関研究員 -
平成 12年
株式会社 デイナベック研究所 研究員
-
平成 18年
千葉大学大学院医学研究院 フェロー 助教
-
平成 22年
東京大学大学院工学研究科 主幹研究員
-
平成 27年
ナノ医療イノベーションセンター 主幹研究員 企画・技術支援チームリーダー
業績
論文
- P. Wen, A. Dirisala, H. Guo, X. Liu, S. Kobayashi, H. Kinoh, T. Anada, M. Tanaka, K. Kataoka, J. Li Engineering durable antioxidative nanoreactors as synthetic organelles for autoregulatory cellular protection against oxidative stress. J Control Release (2025) DOI: 10.1016/j.jconrel.2025.113683
- Y. Honda, S. Nagao, H. Kinoh, X .Liu , N. Matsudaira, A. Dirisala, S. Nitta-Matsutomo , T. Nomoto, H. Hayashita-Kinoh, Y. Miura, T. Okada 5, N. Nishiyama Adeno-Associated Virus Self-Assembled with Tannic Acid and Phenylboronic Acid Polymers to Evade Neutralizing Antibodies and Reduce Adverse Events. ACS Nano. 2025 Mar 4;19(8):7690-7706. doi: 10.1021/acsnano.4c11085.
- Chen P, Yang W, Mochida Y, Li S, Hong T, Kinoh H, Kataoka K, Cabral H. Selective Intracellular Delivery of Antibodies in Cancer Cells with Nanocarriers Sensing Endo/Lysosomal Enzymatic Activity Angew Chem Int Ed Engl. (2024) Feb 11:e202317817. doi: 10.1002/anie.202317817.
- Mpekris F, Panagi M, Michael C, Voutouri C, Tsuchiya M, Wagatsuma C, Kinoh H, Osada A, Akinaga S, Yoshida S, Martin JD, Stylianopoulos T. J Control Release. (2023) Jan;353:956-964. doi: 10.1016/j.jconrel.2022.12.016.
- Y. Tao , Y. Mochida Y, X Liu, H. Zhou, J. Xie, H. Kinoh, H. Cabral, K. Kataoka. Conjugation of glucosylated polymer chains to checkpoint blockade antibodies augments their efficacy and specificity for glioblastoma. Nat. Biomed Eng. 5(11):1274-1287.(2021)
- J. Li, Z. Ge, K. Toh, X. Liu, A. Dirisala, W. Ke, P. Wen, Hang Zhou, Zheng Wang, Shiyan Xiao, Joachim F. R. Van Guyse, Theofilus A. Tockary, Jinbing Xie, Daniel Gonzalez‐Carter, H. Kinoh, Satoshi Uchida, Yasutaka Anraku, Kazunori Kataoka. Enzymatically Transformable Polymersome‐Based Nanotherapeutics to Eliminate Minimal Relapsable Cancer. Adv Mater. 7:e2105254. (2021)
- W. Paraiso, J. G.-Chica, X. Ariza, S. Zagmutt, S. Fukushima, J. G. Gomez, Y. Mochida, D. Serra, L. Herrero, H. Kinoh, N. Casals, K. Kataoka, R. R.-Rodriguez, S. Quader, Poly-ion complex micelle effectively delivers CoA-conjugated CPT1A inhibitors to modulate lipid metabolism in brain cells. Biomater. Sci. 9(21):7076-7091. (2021)
- H. Shibasaki, H. Kinoh, H. Cabral, S. Quader, Y. Mochida, X. Liu, K. Toh, K. Miyano, Y. Matsumoto, T. Yamasoba, K. Kataoka. Efficacy of pH-Sensitive Nanomedicines in Tumors with Different c-MYC Expression Depends on the Intratumoral Activation Profile. ACS Nano. 15(3):5545-5559. (2021)
- S. Quader, X. Liu, K. Toh, Y.-L. Su, A. R. Maity, A. Tao, W. K. D. Paraiso, Y. Mochida, H. Kinoh, H. Cabral, K. Kataoka, Supramolecularly enabled pH- triggered drug action at tumor microenvironment potentiates nanomedicine efficacy against glioblastoma. Biomaterials 267 120463 (2021)
- H Cabral, H Kinoh, K Kataoka. Tumor-Targeted Nanomedicine for Immunotherapy. Acc Chem Res 53(12):2765-2776. (2020)
- H. Kinoh, S. Quader, H. Shibasaki, X. Liu, A. Maity, T. Yamasoba, H. Cabral, K. Kataoka, Translational nanomedicine boosts anti-PD1 therapy to eradicate orthotopic PTEN-negative glioblastoma. ACS Nano 14 Issue 8, 10127-10140 (2020)
- A. Dirisala, S. Uchida, K. Toh, J. Li, S. Osawa, T. A. Tockary, X. Liu, S. Abbasi, K. Hayashi, Y. Mochida, S. Fukushima, H. Kinoh, K. Osada, K. Kataoka, Transient stealth coating of liver sinusoidal wall by anchoring two-armed PEG for retargeting nanomedicines. Sci. Adv. 6 (26) eabb8133 (2020)
- M. M. Lübtow, S. Oerter, S. Quader, E. Jeanclos, A. Cubukova, M. Krafft, C. Schulte, L. Meier, M. Rist, O. Sampetrean, H. Kinoh, A. Gohla, K. Kataoka, A. A.-Menzel, R. Luxenhofer, In vitro blood-brain-barrier permeability and cytotoxicity of atorvastatin-loaded nanoformulation against glioblastoma in 2D and 3D models. Mol. Pharm. 17 Issue6 1835-1847 (2020)
- H. Kinoh, H. Shibasaki, X. Liu, T. Yamasoba, H. Cabral, K. Kataoka, Nanomedicines blocking adaptive signals in cancer cells overcome tumor TKI resistance. J. Control. Release 321 132-144 (2020)
- T. A. Tockary, W. Foo, A. Dirisala, Q. Chen, S. Uchida, S. Osawa, Y. Mochida, X. Liu, H. Kinoh, H. Cabral, K. Osada, K. Kataoka, Single-stranded DNA-packaged polyplex micelle as adeno-associated-virus-inspired compact vector to systemically target stroma-rich pancreatic cancer. ACS Nano 13 Issue11 12732-12742 (2019)
- S. Watanabe, K. Hayashi, K. Toh, H. J. Kim, X. Liu, H. Chaya, S. Fukushima, K. Katsushima, Y. Kondo, S. Uchida, S. Ogura, T. Nomoto, H. Takemoto, H. Cabral, H. Kinoh, H. Tanaka, M. R. Kano, Y. Matsumoto, H. Fukuhara, S. Uchida, M. Nangaku, K. Osada, N. Nishiyama, K. Miyata, K. Kataoka, In vivo rendezvous of small nucleic acid drugs with charge-matched block catiomers to target cancer. Nat. Commun. 10 1894 (2019)
- W. Ke, J. Li, F. Mohammed, Y. Wang, K. Tou, X. Liu, P. Wen, H. Kinoh, Y. Anraku, H. Chen, K. Kataoka, Z. Ge, Therapeutic polymersome nanoreactors with tumor-specific activable cascade reactions for cooperative cancer therapy. ACS Nano 13 Issue 2 2357-2369 (2019)
- Y. Yi, H. J. Kim, M. Zheng, P. Mi, M. Naito, B S Kim, H. S. Min, K. Hayashi, F.Perche, K. Toh, X. Liu, Y. Mochida, H. Kinoh, H. Cabral, K. Miyata, K. Kataoka. Glucose-linked sub-50-nm unimer polyion complex-assembled gold nanoparticles for targeted siRNA delivery to glucose transporter 1-overexpressing breast cancer stem-like cells. Journal of controlled release 295: 268-277 (2019)
- J. Zhang, H. Kinoh, L. Hespel, X. Liu, S. Quader, J. Martin, T. Chida, H. Cabral, K. Kataoka, Effective treatment of drug resistant recurrent breast tumors harboring cancer stem-like cells by staurosporine/epirubicin co-loaded polymeric micelles. J. Control. Release 264 127-135 (2017)
- K. Miyano, H. Cabral, Y. Miura, Y. Matsumoto, Y. Mochida, H. Kinoh, K. Iwata, O. Nagato, H. Saya, N. Nishiyama, K. Kataoka, T. Yamasoba, cRGD peptide installation on cisplatin-loaded nanomedicines enhances efficacy against locally advanced head and neck squamous cell carcinoma bearing cancer stem-like cells. J. Control. Release 261 275-286 (2017)
- H. Kinoh, Y. Miura, T. Chida, X. Liu, K. Mizuno, S. Fukushima, Y. Morodomi, N. Nishiyama, H. Cabral, K. Kataoka, Nanomedicines eradicating cancer stem-like cells in vivo by pH-triggered intracellular cooperative action of loaded drugs. ACS Nano 10 (6) 5643-5655 (2016)
- S. Uchida S, H. Kinoh, T.Ishii, Matsui A, Tockary TA, Takeda KM, Uchida H, Osada K, Itaka K, K.Kataoka. Systemic delivery of messenger RNA for the treatment of pancreatic cancer using polyplex nanomicelles with a cholesterol moiety. Biomaterials Mar;82:221-8. (2016)
- J.Makino, H. Cabral, Y. Miura, Y. Matsumoto, M. Wang, H. Kinoh, Y. Mochida, N. Nishiyama, K. Kataok. cRGD-installed polymeric micelles loading platinum anticancer drugs enable cooperative treatment against lymph node metastasis. J Control Release. S0168-3659(15)30183-8. (2015)
- H. Wu, H. Cabral H, K. Toh , P Mi, YC Chen, Y. Matsumoto, N. Yamada, X. Liu, H. Kinoh, Y. Miura, Kano MR, H. Nishihara, N. Nishiyama, K. Kataoka. Polymeric micelles loaded with platinum anticancer drugs target preangiogenic micrometastatic niches associated with inflammation. J Control Release. 189:1-10. (2014)
- S. Quader, Cabral H, Mochida Y, Ishii T, Liu X, Toh K, H. Kinoh, Y. Miura, N. Nishiyama, K. Kataoka. Selective intracellular delivery of proteasome inhibitors through pH-sensitive polymeric micelles directed to efficient antitumor therapy. J Control Release. 188:67-77 (2014)
- Q Chen, K Osada, T Ishii , Oba M, Uchida S, Tockary TA, Endo T, Ge Z, H Kinoh, Kano MR, Itaka K, Kataoka K. Homo-catiomer integration into PEGylated polyplex micelle from block-catiomer for systemic anti-angiogenic gene therapy for fibrotic pancreatic tumors. Biomaterials. 33(18):4722-30. (2012)
- Y Morodomi Y, T Yano, H Kinoh, Y Harada, S Saito, R Kyuragi, K Yoshida, M Onimaru, F Shoji, T Yoshida, K Ito , Y Shikada, R Maruyam, M Hasegawa, Y Maehara , Y Yonemitsu. BioKnife, a uPA activity-dependent oncolytic Sendai virus, eliminates pleural spread of malignant mesothelioma via simultaneous stimulation of uPA expression. Mol Ther. 20(4):769-77 (2012)
- T Kato T, Y Ueda, H Kinoh, Y Yoneyama, A Matsunaga, A Komaru, Y Harada, H Suzuki, A Komiya, S Shibata , M Hasegawa, H Hayashi, T Ichikawa, Y Yonemitsu. RIG-I helicase-independent pathway in sendai virus-activated dendritic cells is critical for preventing lung metastasis of AT6.3 prostate cancer. Neoplasia. 12(11):906-14. (2010)
- Y Hasegawa, H. Kinoh, Y Iwadate, M Onimaru, Y Ueda, Y Harada, S Saito, A Furuya , T Saegusa, Y Morodomi, M Hasegawa, S Saito, I Aoki, N Saeki, Y Yonemitsu. Urokinase-targeted fusion by oncolytic Sendai virus eradicates orthotopic glioblastomas by pronounced synergy with interferon-β gene. Mol Ther. 18(10):1778-86 (2010)
- A Komaru, Y Ueda, A Furuya, S Tanaka, K Yoshida, T Kato, H Kinoh, Y Harada, H Suzuki, M Inoue, M Hasegawa, T Ichikawa, Y Yonemitsu. Sustained and NK/CD4+ T cell-dependent efficient prevention of lung metastasis induced by dendritic cells harboring recombinant Sendai virus. J Immunol 183(7): 4211-9. (2009)
- Y Harada, Y Ueda, H Kinoh, A Komaru, T Fuji-Ogawa, A Furuya, A Iida, M Hasegawa, T Ichikawa, Y Yonemitsu. Cytokine-based log-scale expansion of functional murine dendritic cells. PLoS One. 4(8): e6674. (2009)
- H Kinoh, M Inoue, A Komaru, Y Ueda, M Hasegawa, Y Yonemitsu. Generation of optimized and urokinase-targeted oncolytic Sendai virus vectors applicable for various human malignancies. Gene Ther. 2009; 16(3): 392-403.
- H Inoue, Iga M, Nabeta, T Yokoo, Y Suehiro, S Okano, M Inoue, H Kinoh, T Katagiri, K Takayama, Y Yonemitsu, M Hasegawa, Y Nakamura, Y Nakanishi, K Tani Non-transmissible Sendai virus encoding granulocyte macrophage colony-stimulating factor is a novel and potent vector system for producing autologous tumor vaccines. Cancer Sci. 99(11):2315-26. (2008)
- Y. Yonemitsu, Y Ueda, H Kinoh, M Hasegawa. Immunostimulatory virotherapy using recombinant Sendai virus as a new cancer therapeutic regimen. Frontiers in bioscience : a journal and virtual library. Front Biosci. 13:1892-8. (2008)
- H Kinoh, Inoue M. New cancer therapy using genetically-engineered oncolytic Sendai virus vector. Front Biosci. 13:2327-34. (2008)
- Y Iwadate, M Inoue, T Saegusa, Y Tokusumi, H Kinoh, M Hasegawa, M Tagawa, A Yamaura, H Shimada. Recombinant Sendai virus vector induces complete remission of established brain tumors through efficient interleukin-2 gene transfer in vaccinated rats. Clin Cancer Res. 11(10):3821-7. (2005)
- H Kinoh, M Inoue, K Washizawa, T Yamamoto, S Fujikawa, Y Tokusumi, A Iida, Y Nagai, M Hasegawa. Generation of a recombinant Sendai virus that is selectively activated and lyses human tumor cells expressing matrix metalloproteinases Gene Ther 11(14):1137-45. (2004)
- K Komori, T Nonaka, A Okada, H Kinoh, Hayashita-Kinoh H, Yoshida N, Yana I, Seiki M. Absence of mechanical allodynia and Abeta-fiber sprouting after sciatic nerve injury in mice lacking membrane-type 5 matrix metalloproteinase. FEBS Lett. 557(1-3):125-8. (2004)
- H Hayashita-Kinoh H, H Kinoh, A Okada, K Komori, Y Itoh, T Chiba, M Kajita, I Yana, M Seiki. Membrane-type 5 matrix metalloproteinase is expressed in differentiated neurons and regulates axonal growth. Cell Growth Differ 2001 Nov;12(11):573-80.
- M Kajita, Y Itoh, T Chiba, H Mori, A Okada, H Kinoh, M Seiki. Membrane-type 1 matrix metalloproteinase cleaves CD44 and promotes cell migration. J Cell Biol. 153(5):893-904. (2001)
- Y Itoh, M Kajita, H Kinoh, H Mori, A Okada, M Seiki. Membrane type 4 matrix metalloproteinase (MT4-MMP, MMP-17) is a glycosylphosphatidylinositol-anchored proteinase J Biol Chem 274(48):34260-6. (1999)
- M Kajita 1, H Kinoh, N Ito, A Takamura, Y Itoh, A Okada, H Sato, M SeikiHuman membrane type-4 matrix metalloproteinase (MT4-MMP) is encoded by a novel major transcript: isolation of complementary DNA clones for human and mouse mt4-mmp transcripts FEBS Lett Sep 3;457(3):353-6. (1999)
- H Kinoh, H Hayashita, M Kajita, A Okada, M SeikiAssignment of the genes for membrane-type-4 matrix metalloproteinase (Mmp17, MMP17) to mouse chromosome 5, human chromosome band 12q24.3 and membrane-type-5 matrix metalloproteinase (Mmp24, MMP24) to mouse chromosome 2 and human chromosome band 20q11.2-->q12, respectively, by radiation hybrid and in situ hybridization. Cytogenet Cell Genet 97-8. (1999)
- K Wada, H Sato, H Kinoh, M Kajita, H Yamamoto, M Seiki. Cloning of three Caenorhabditis elegans genes potentially encoding novel matrix metalloproteinases. Gene 211(1):57-62. (1998)
- K Nomura, T Shimizu, H Kinoh, Y Sendai, M Inomata, N Suzuki. Sea urchin hatching enzyme (envelysin): cDNA cloning and deprivation of protein substrate specificity by autolytic degradation. Biochemistry 36(23):7225-38. (1997)
- Y Tsunezuka, H Kinoh, T Takino, Y Watanabe, Y Okada, A Shinagawa, H Sato, M Seiki. Expression of membrane-type matrix metalloproteinase 1 (MT1-MMP) in tumor cells enhances pulmonary metastasis in an experimental metastasis assay. Cancer Res 56(24):5678-83. (1996)
- H Kinoh, H Sato, Y Tsunezuka, T Takino, A Kawashima, Y Okada, M Seiki. MT-MMP, the cell surface activator of proMMP-2 (pro-gelatinase A), is expressed with its substrate in mouse tissue during embryogenesis. J Cell Sci 109 ( Pt 5):953-9. (1996)
- H Abe, H Kinoh, N Suzuki Seasonal variations in the production of the egg-jelly macromolecule, a fucose sulphate glycoconjugate, by the accessory cells in the ovary of the sea urchin Hemicentrotus pulcherrimus Rouxs Arch Dev Biol 402-410. (1994)
- H Kinoh, T Shimizu, H Fujimoto, N Suzuki. Expression of a putative precursor mRNA for sperm-activating peptide I in accessory cells of the ovary in the sea urchin Hemicentrotus pulcherrimus. Rouxs Arch Dev Biol 1994 Aug;203(7-8):381-388.
- Y Satoh 1, T Shimizu, Y Sendai, H Kinoh, N Suzuki. Nucleotide sequence of the proton ATPase beta-subunit homologue of the sea urchin Hemicentrotus pulcherrimus. Zoolog Sci 1994 Feb;11(1):153-6.
- H Abe, H Kinoh, T Oikawa, N Suzuki. The egg-jelly macromolecule, a fucose sulphate glycoconjugate, originates from the accessory cells of the ovary in the sea urchin Hemicentrotus pulcherrimus. Rouxs Arch Dev Biol 1992 May;201(3):179-189
- https://iconm.kawasaki-net.ne.jp/kklab/research/research2-1je.html を参照
特許
- 特願 JP2024-162530 (2024.9) 出願人:公益財団法人川崎市産業振興財団 発明人喜納宏昭、Thi Kim Dung Doan, 劉学瑩、サビーナ・カダール・片岡一則【発明の名称】:水性分子のためのミセル、および当該ミセルを用いた疎水性分子の送達方法、ならびに当該方法に用いるための疎水性分子を内包したミセルを含む組成物
- 特願JP2024-124555 (2024.7) 出願人;公益財団法人川崎市産業振興財団, 金沢大学、関西医大 発明人:喜納宏昭、坂本毅治 他【発明の名称】B型肝炎ウイルスに対する治療および予防用ワクチン
- 特願 JP2024-082791 (2024.10) 出願人:東京大学、公益財団法人川崎市産業振興財団発明人:喜納宏昭、宮田完二郎、他【発明の名称】 血小板を媒介にした肺転移がんへの核酸医薬デリバリー用高分子材料に関する研究
- 出願番号:PCT/JP2023/017950、発明の名称:医薬、キット及びシステム 発明者:喜納宏昭、片岡一則 他4名、出願人:公益財団法人川崎市産業振興財団、出願日:2022.5.13
- 出願番号:PCT/JP2021/024675 発明の名称:(フル抗体(免疫チックポイント阻害剤)送達する)抗原への結合親和性を低減させた抗体 発明人:片岡 一則、安楽 泰孝、持田 祐希、楊 涛、カブラル オラシオ、喜納 宏昭
- 出願番号:PCT/JP2020/021301、 発明の名称:複合体、医薬、癌治療剤、キット及び結合体 発明者:喜納宏昭、片岡一則 他5名、出願人:公益財団法人川崎市産業振興財団
- 出願番号:PCT/JP2020/003432、 発明の名称: アントラサイクリン系化合物を含むミセル剤と免疫賦 活剤との組み合わせ医薬 発明者:喜納宏昭、片岡一則 他8名、出願人:公益財団法人川崎市産業振興財団
- 出願番号:PCT/JP2019/006780、発明の名称:医薬組成物 、発明者:喜納宏昭、片岡一則 他6名、出願人:公益財団法人川崎市産業振興財団、
- 出願番号:PCT/JP2019/006861、発明の名称:医薬組成物 、発明者:喜納宏昭、片岡一則 他6名、出願人:公益財団法人川崎市産業振興財団
- 出願番号:PCT/JP2017/30150、発明の名称:ポリマー、ポリマーの製造方法、及び薬物複合体 、発明者:喜納宏昭、片岡一則 他2名、出願人:公益財団法人川崎市産業振興財団、出願日:2019.2.22 ポリマー、ポリマーの製造方法、及び薬物複合体 特願2016-163134
- 発明の名称:耐性癌、転移癌を有する患者において耐性癌、転移癌を治療するための医薬組成物であり、スタウロスポリンまたはその類似体を含む医薬組成物
出願人:東京大学 東京工業大学
発明者:喜納宏昭 片岡一則 Horacio Cabral 三浦 裕 福島 重人 - 発明の名称:プロテアーゼ依存性トロピズムが改変された細胞融合ベクター
出願人:(株)ディナベック研究所
発明者:喜納宏昭、井上誠、飯田章博、長谷川護 - 発明の名称:パラミクソウイルスベクターの血管への遺伝子導入用途
出願人:(株)ディナベック研究所
発明者:真崎 一郎、米満 吉和、居石 克夫、長谷川 護、喜納 宏昭 - 発明の名称:遺伝子治療用ウイルスベクター
出願人:九州大学、ディナベック株式会社
発明者:谷 憲三朗、長谷川 護、井上誠、喜納 宏昭
所属学会
- 日本遺伝子細胞治療学会 評議員
- 日本癌学会
- 日本DDS学会
- 日本バイオマテリアル学会
- 日本分子生物学会
- 日本呼吸器学会
- 日本がん免疫学会
- 日本がん分子標的学会
採択されている研究費とこれまで受けた研究費
日本医療研究開発機構 次世代治療・診断実現のための創薬基盤技術開発事業:次世代送達技術を用いた医薬品研究開発 代表(R6~R11)課題名:革新的リガンド化マルチターゲットsiRNAとナノマシン複合体を用いた効果的な腫瘍ターゲッティングによる世界初がん根治技術開発
科学研究費補助金・基盤研究(B) 代表(R6~R9・文部科学省)課題名:リガンド核酸医薬搭載DDSシステムを用いた肺線維症(IPF)標的化治療法の開発
日本医療研究開発機構 次世代がん医療加速化研究事業 分担(R5-R6)課題名:抗体のポリマー修飾に基づく革新的免疫チェックポイント阻害剤の開発
科学研究費補助金・基盤研究(B) 分担(R4~R6) 課題名: Cold tumorをhot tumorに変える不安定鉄キレート技術の創出
科学研究費補助金・基盤研究(C) 分担(R4~R6) 課題名:Nanomedicine-based Chemo-Immunotherapy for the Treatment of Pediatric Brain Cancer
科学研究費補助金・基盤研究(C) 分担(R4~R6) 課題名:デュシェンヌ型筋ジストロフィーの遺伝子治療を目指した免疫応答回避性薬剤の開発
国際共同研究加速基金(国際共同研究強化(B))分担(R3~R6) 課題名:がん関連線維芽細胞の精密標的により免疫療法をブーストするナノ治療薬の開発
日本医療研究開発機構 先端的バイオ創薬等基盤技術開発事業 分担(H31~R5) 課題名:高分子ナノテクノロジーを基盤とするバイオ医薬品送達システムの開発
科学研究費補助金・基盤研究(B)代表 課題名:難治癌の腫瘍間質による免疫チェックポイント阻害剤耐性を克服するナノ治療薬の開発
科学研究費補助金・基盤研究(C) 代表 課題名:再発する難治がんに存在する治療抵抗性がん幹細胞を標的とする新規ナノミセルの創出